physica
konsep termodinamika
tujuan pembelajaran
1.memudahkan kita dalam memahami konsep-konsep termodinamika
2.mengetahui hukum-hukum termodinamika
3.membahas soal-soal mengenai termodinamika
apasih termodinamika itu?
Termodinamika (bahasa Yunani: thermos = 'panas' and dynamic = 'perubahan') adalah fisika energi , panas, kerja, entropi dan kespontanan proses. Termodinamika berhubungan dekat dengan mekanika statistik di mana hubungan termodinamika berasal.
Pada sistem di mana terjadi proses perubahan wujud atau pertukaran energi, termodinamika klasik tidak berhubungan dengan kinetika reaksi (kecepatan suatu proses reaksi berlangsung). Karena alasan ini, penggunaan istilah "termodinamika" biasanya merujuk pada termodinamika setimbang. Dengan hubungan ini, konsep utama dalam termodinamika adalah proses kuasistatik, yang diidealkan, proses "super pelan". Proses termodinamika bergantung-waktu dipelajari dalam termodinamika tak-setimbang.
Karena termodinamika tidak berhubungan dengan konsep waktu, telah diusulkan bahwa termodinamika setimbang seharusnya dinamakan termostatik.
apa aja ya yg termasuk konsep-konsep termodinamika itu?
Sifat-sifat Sistem
Keadaan sistem bisa diidentifikasi atau diterangkan dengan besaran yang bisa diobservasi seperti volume, temperatur, tekanan, kerapatan dan sebagainya. Semua besaran yang mengidentifikasi keadaan sistem disebut sifat-sifat sistem.
Klasifikasi Sifat-sifat Sistem
Sifat-sifat termodinamika bisa dibagi atas dua kelompok umum:
1. Sifat ekstensif, dan
2. Sifat intensif.
1. Sifat ekstensif
Besaran sifat dari sistem dibagi ke dalam beberapa bagian. Sifat sistem, yang harga untuk keseluruhan sistem merupakan jumlah dari harga komponen-komponen individu sistem tersebut, disebut sifat ekstensif. Contohnya, volume total, massa total, dan energi total sistem adalah sifat-sifat ekstensif.
2. Sifat intensif
Perhatikan bahwa temperatur sistem bukanlah jumlah dari temperatur-temperatur bagian sistem. Begitu juga dengan tekanan dan kerapatan sistem. Sifat-sifat seperti temperatur, tekanan dan kerapatan ini disebut sifat intensif.
Kesetimbangan Termal
Misalkan dua benda yang berasal dari material yang sama atau berbeda, yang satu panas, dan lainnya dingin. Ketika benda ini ditemukan, benda yang panas menjadi lebih dingin dan benda yang dingin menjadi lebih panas. Jika kedua benda ini dibiarkan bersinggungan untuk beberapa lama, akan tercapai keadaan dimana tidak ada perubahan yang bisa diamati terhadap sifat-sifat kedua benda tersebut. Keadaan ini disebut keadaan kesetimbangan termal, dan kedua benda akan mempunyai temperatur yang sama.
Bentuk-bentuk energi
energi dapat terwujud dalam berbagai bentuk, yaitu energi kimia, energi panas, energi mekanis, energi listrik, energi nuklir, energi gelombang elektromagnetik, energi gaya magnit, dan lain-lain. Suatu media pembawa energi dapat mengandung berbagai bentuk energi tersebut sekaligus, dan jumlah energinya disebut energi total (E). Dalam analisis thermodinamika sering digunakan energi total setiap satuan masa media (m), yang disebut sebagai energi per-satuan masa (e) yaitu,
Berbagai bentuk energi diatas dapat pula dikelompokkan menjadi dua bentuk, yaitu energi makroskopik dan energi mikroskopik. Energi makroskopik adalah keberadaan energi ditandai dari posisinya terhadap lingkungannya atau terhadap suatu referensi yang ditentukan. Contoh bentuk energi makroskopik adalah energi kinetik (KE) dan energi potensial (PE). Keberadaan energi mikroskopik ditentukan oleh struktur internal dari= zat pembawa energi sendiri dan tidak tergantung kepada lingkungannnya, yaitu struktur dan gerakan molekul zat tersebut. Energi mikroskopik ini disebut sebagai energi internal (U).
Energi makroskopik berhubungan dengan gerakan masa pembawa energi, dan pengaruh luar seperti gaya gravitasi, pengaruh energi listrik, sifat magnit, dan tegangan pemukaan fluida. Energi kinetis KE adalah energi yang disebabkan oleh gerakan relatif terhadap suatu referensi, dan besarnya adalah:
atau dalam bentuk energi per-satuan masa:
dengan, m = satuan masa media pembawa energi
V = satuan kecepatan gerakan masa.
Energi potensial adalah energi yang disebabkan oleh posisi elevasinya dalam medan gravitasi, dan besarnya adalah:
PE = m g z
Atau dalam bentuk energi per-satuan masa,
pe = g z
dengan, g = gaya gravitasi
z = posisi elevasi terhadap suatu referensi.
Energi internal meliputi semua jenis energi mikroskopik, yaitu akibat dari struktur dan aktivitas molekul dalam masa yang ditinjau. Struktur molekul adalah jarak antar molekul dan besar gaya tarik antar molekul, sedang aktivitas molekul adalah kecepatan gerak molekul. Energi laten adalah energi yang merubah jarak dan gaya tarik antar molekul, sehingga masa berubah fase antara fase padat atau cair menjadi gas. Energi sensibel merubah kecepatan gerak molekul, yang ditandai oleh perubahan temperatur dari masa yang ditinjau. Energi kimia adalah energi internal sebagai akibat dari komposisi kimia sua tu zat, yang merupakan energi yang mengikat atom dalam molekul zat tersebut. Perubahan struktur atom menyebabkan perubahan energi pengikat atom dalam molekul, sehingga reaksinya dapat melepaskan energi (eksothermis) misalnya dalam reaksi pembakaran, atau memerlukan energi (indothermis). Bentuk energi internal lainnya adalah energi nuklir, yang merupakan energi ikatan antara atom dengan intinya.
Dalam bahasan thermodinamika efek dari jenis energi makroskopik lain yaitu energi magetik, dan tegangan permukaan fluida dapat diabaikan, sehingga energi total E dari masa pembawa energi tersebut adalah:
E = U + KE + PE = U +
atau dalam bentuk energi per-satuan masa,
e = u +ke +pe = u +
Dalam aplikasi bidang teknik masa atau sistem thermodinamika yang ditinjau biasanya tidak bergerak selama proses berlangsung, sehingga perubahan energi potensial dan energi kinetisnya sama dengan nol.
Persamaan keadaan gas ideal dan diagram P-v-T
Volume dikecilkan Suhu dinaikkan
tekanan naik panjang bertambah
`Apabila volume (V), suhu (T) dan massa (m) diatur dengan nilai tertentu, maka nilai tekanan (P) tidak bisa sebarang. Ada hubungan antara besaran-besaran ini sbb: f(P, V, T, m) = 0
Hubungan ini disebut persamaan keadaan.Biasanya persamaan keadaan dituliskan berdasarkan sifat-sifat alam bukan berapa banyakmaterial berada, sehingga besaran ekstensif diganti dengan nilai spesifiknya. Seperti V menjadi v =
Persamaan ini bervariasi dari satu zat ke zat yang lain. Hubungan antar satu sama lain biasanya tidak sederhana. Untuk mempermudah, sering dipakai ilustrasi grafik. Contoh eksperimen untuk 1 mole gas karbon dioksida:
Plot antara Pv/T vs. P untuk tiga temperatur yang berbeda.
Ilustrasi grafik tersebut menunjukkan:
§ Tampak bahwa nilai Pv/T tidak konstan
§ Pada tekanan rendah ketiga kurva menyatu pada nilai Pv/T = R dengan Rmerupakan konstanta gas universal.
§ Pada suhu tinggi, kurva mendekati garis lurus
Pada tekanan yang cukup rendah, untuk semua gas:
Pv/T = R atau Pv = RT
Persamaan gas ideal:
Pv = RT
karena v = maka persamaan gas ideal juga dapat ditulis
PV = nRT
Permukaan kurva gas ideal
Proses-Proses dalam termodinamika
Proses Isokoris (volume konstan)
Bila volume konstan, p/T = konstan,
pi/ Ti = pf/Tf
Pada proses ini DV = 0, maka usaha yang dilakukan W = 0, sehingga
Q = DU = n cv DT
Proses Isobaris (tekanan konstan)
Bila tekanan konstan, V/T = konstan,
Vi/ Ti = Vf/Tf
Pada proses ini usaha yang dilakukan W = p DV = p (Vf - Vi ) , sehingga
DU = Q - W
DU = n cp DT - p DV
Proses Isotermis (temperatur konstan)
Bila temperatur konstan, pV = konstan,
Vo disini Pv = RT = konstan, sering disebut sebagai “Hukum Boyle”.
piVi = pfVf
Pada proses ini DT = 0, maka perubahan tenaga internal DU = 0, dan usaha yang dilakukan :
W = ò p dV
p = nRT/V, maka
W = nRT ò (1/V) dV
W = nRT ln (Vf/Vi)
Q = W
Proses Adiabatis
Pada proses ini tidak ada kalor yang masuk, maupun keluar dari sistem, Q = 0. Pada proses adiabatik berlaku hubungan pVg= konstan (buktikan),
piVgi = pfVgf
Usaha yang dilakukan pada proses adiabatis :
W = ò p dV
p = k/Vg , k = konstan , maka
W = ò (k/Vg ) dV
W = 1/(1-g) { pfVf - piVi}
DU = -w

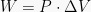





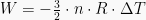







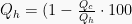
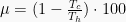
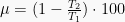
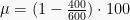

Hukum Termodinamika
Pada termodinamika, terdapat 4 hukum yang berlaku secara universal.
Hukum Termodinamika 0
Hukum termodinamika 0 menjelaskan kesetimbangan termal berlaku universal, dengan kata lain apapun zat atau materi benda akan memiliki kesetimbangan termal yang sama bila disatukan.
“Jika dua sistem berada dalam kesetimbangan termal dengan sistem ketiga, maka mereka berada dalam kesetimbangan termal satu sama lain”
Hukum Termodinamika 1
Hukum termodinamika 1 menunjukkan hukum kekekalan energi.
“Energi tidak dapat diciptakan ataupun dimusnahkan, melainkan hanya bisa diubah bentuknya saja”
Terdapat persamaan matematik yang menjelaskan hukum ini, yaitu:
Dimana 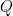 adalah kalor/panas yang diterima/dilepas (J),
adalah kalor/panas yang diterima/dilepas (J),  adalah energi/usaha (J), dan
adalah energi/usaha (J), dan  adalah perubahan energi (J). J adalah satuan internasional untuk energi atau usaha, yaitu Joule. Dari persamaan tersebut dapat diketahui bahwa seluruh kalor yang diterima atau dilepas oleh benda akan dijadikan usaha ditambahkan dengan perubahan energi.
adalah perubahan energi (J). J adalah satuan internasional untuk energi atau usaha, yaitu Joule. Dari persamaan tersebut dapat diketahui bahwa seluruh kalor yang diterima atau dilepas oleh benda akan dijadikan usaha ditambahkan dengan perubahan energi.
Hukum 2 Termodinamika
Hukum 2 termodinamika menunjukkan kondisi alami dari alur kalor suatu objek dengan sistem.
“Kalor mengalir secara alami dari benda yang panas ke benda yang dingin; kalor tidak akan mengalir secara spontan dari benda dingin ke benda panas tanpa dilakukan usaha”
Hukum Termodinamika 3
“Entropi dari suatu kristal sempurna pada absolut nol adalah sama dengan nol,”
Proses-proses Termodinamika
Proses termodinamika terbagi menjadi empat macam, tergantung dari keadaan tekanan, volume, dan suhu saat terjadinya proses tersebut. Proses-proses tersebut umumnya digambarkan dalam diagram P-V, yaitu diagram yang menggambarkan tekanan (P) dan volume (V) saat proses terjadi. Ada dua hal penting yang harus diingat dari berbagai jenis proses-proses termodinamika, yaitu variabel yang berubah dan usaha yang dilakukan. Usaha yang terjadi pada suatu proses termodinamika dapat diketahui dengan menghitung luasan grafik P-V.
Isobarik
Isobarik adalah proses termodinamika yang tidak mengubah nilai tekanan sistem ( ). Nilai usaha dapat dihitung dengan persamaan berikut.
). Nilai usaha dapat dihitung dengan persamaan berikut.
Dari rumus tersebut, diketahui juga bahwa apabila volume membesar (terjadi pemuaian) maka usaha bernilai positif, dan bila volume mengecil (terjadi penyusutan) maka usaha bernilai negatif.

Sumber gambar: figures.boundless-cdn.com
Isokhorik
Isokhorik adalah proses termodinamika yang tidak mengubah nilai volume sistem ( ). Pada proses ini, nilai usaha adalah 0 karena tidak terdapat suatu luasan bangun yang terdapat pada gambar P-V.
). Pada proses ini, nilai usaha adalah 0 karena tidak terdapat suatu luasan bangun yang terdapat pada gambar P-V.

Sumber gambar: cft.fis.uc.pt
Isotermik
Isotermik adalah proses termodinamika yang tidak mengubah nilai suhu sistem (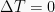 ).
).

Sumber gambar: bu.edu
Nilai usaha pada proses isotermik dinyatakan dengan persamaan berikut:
Dimana n adalah jumlah zat yang dinyatakan dengan satuan mol, R adalah konstanta gas, dan T adalah suhu. Rumus ini didapatkan dengan menggabungkan persamaan usaha di diagram P-V dengan persamaan gas ideal.
Adibatik
Adiabatik adalah proses termodinamika yang tidak mengubah nilai kalor sistem ( ).
).

Sumber gambar: gsu.edu
Pada gas monoatomic, usaha yang dilakukan pada proses adiabatik dapat dinyatakan dengan persamaan:
Jika diperhatikan dengan sekilas, proses adiabatik dan isotermik memiliki diagram P-V yang serupa. Secara detil, dapat dilihat bahwa proses adiabatik memiliki kemiringan yang lebih curam dibandingkan proses isotermik seperti contoh grafik berikut.

i.stack.imgur.com
Patut diingat bahwa satuan-satuan yang digunakan dalam perhitungan adalah Satuan Internasional. Sebagai contoh, satuan untuk suhu yang digunakan adalah Kelvin, satuan untuk volume adalah m3, dan satuan untuk jumlah zat adalah mol.

kias.dyndns.org
Mesin Carnot dan mesin kalor
Mesin Carnot adalah suatu model mesin ideal yang memiliki efisiensi paling tinggi dari semua mesin yang mungkin diciptakan. Mesin Carnot bekerja berdasarkan suatu proses termodinamika yang membentuk siklus, disebut juga siklus Carnot.
Pada siklus Carnot, terdapat 4 proses, yaitu pemuaian Isotermal dari A ke B, pemuaian adiabatic dari B ke C, pemampatan isothermal dari C ke D, dan pemampatan adiabatic dari D ke A. Selama proses siklus Carnot sistem menerima kalor Qh dari reservoir bersuhu tinggi Th dan melepas kalor Qc ke reservoir bersuhu rendah Tc

Siklus carnot pada mesin carnot
Usaha yang dilakukan oleh mesin Carnot dapat dinyatakan dengan mengaplikasikan Hukum Termodinamika 1.
Sedangkan, untuk mengukur efisiensi mesin dapat digunakan persamaan-persamaan berikut.
Dikarenakan pada siklus Carnot berlaku hubungan  , efisiensi mesin Carnot juga dapat dinyatakan dengan:
, efisiensi mesin Carnot juga dapat dinyatakan dengan:
Jika dilihat pada rumus efisiensi tersebut, nilai efisiensi 100% dapat diperoleh jika  . Hal ini tidak mungkin terjadi di dunia nyata, sehingga dapat disimpulkan bahwa tidak ada sistem di dunia nyata yang mampu mencapai efisiensi 100%.
. Hal ini tidak mungkin terjadi di dunia nyata, sehingga dapat disimpulkan bahwa tidak ada sistem di dunia nyata yang mampu mencapai efisiensi 100%.
Contoh Soal Hukum Termodinamika dan Mesin Carnot
Soal 1
Suatu gas memiliki volume awal 10 m3 dipanaskan dengan kondisi isobaris hingga volume akhirnya menjadi 25 m3. Jika tekanan gas adalah 2 atm, tentukan usaha luar gas tersebut! (1 atm = 1,01 x 105 Pa).
Jawab:
Diketahui:
V2 = 25 m3
V1 = 10 m3
P = 2 atm = 2,02 x 105 Pa
V1 = 10 m3
P = 2 atm = 2,02 x 105 Pa
Ditanyakan: W?
Isobaris → Tekanan Tetap, gunakan rumus W = P (ΔV)
W = P(V2 − V1)
W = 2,02 x 105 x (25 − 10) = 3,03 x 106 joule
Isobaris → Tekanan Tetap, gunakan rumus W = P (ΔV)
W = P(V2 − V1)
W = 2,02 x 105 x (25 − 10) = 3,03 x 106 joule
Soal 2
Mesin Carnot bekerja pada suhu tinggi 600 K, untuk menghasilkan kerja mekanik. Jika mesin menyerap kalor 600 J dengan suhu rendah 400 K, maka usaha yang dihasilkan adalah…. (UN Fisika 2009 P04 No. 18)
Jawab:
Diketahui:
T2 = 400 K
T1 = 600 K
T1 = 600 K
Ditanyakan: Wdihasilkan?
Wdihasilkan = . Wserap = = 200 J
Komentar
Posting Komentar